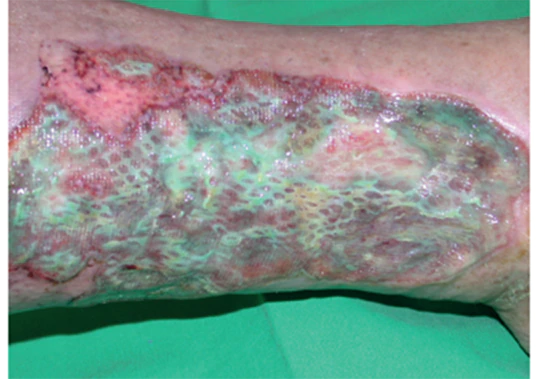
I biofilm sono generalmente comunità polimicrobiche, adese l’una all’altra o ad una superficie, che vengono racchiuse all’interno di una sostanza polimerica extracellulare (EPS). La maggior parte dei biofilm situati sul letto delle ferite croniche sono composti dal 10% al 20% da microrganismi e dall’80% al 90% di EPS. I biofilm bloccano le ferite croniche in uno stato infiammatorio, e si ritiene che siano la causa principale di circa l’80% di tutte le infezioni nell’uomo, e della maggior parte delle infezioni correlate ai dispositivi medici. La letteratura indica la prevalenza di biofilm nelle ferite croniche fino al 78,2%, sebbene una stima più prudente suggerisca che la cifra possa essere del 60%. I biofilm nelle ferite croniche sono difficili da identificare clinicamente e da diagnosticare, sia che si trovino sulla superficie di una ferita o più in profondità nel letto della stessa.
La formazione e l’attività del biofilm sono un ciclo infinito, declinabile nelle seguenti cinque fasi:
- Attaccamento: i microrganismi aderiscono in maniera ancora reversibile su una superficie,
- Colonizzazione: i microrganismi aderiscono irreversibilmente alla superficie tramite interazioni idrofile/idrofobiche forti e tramite flagelli, pili, lipo- e eso-polisaccaridi, proteine adesive legate al collagene, ecc.,
- Sviluppo: le cellule multistrato si accumulano e comincia la produzione e secrezione dell’EPS,
- Maturazione: formazione stabile di una comunità tridimensionale che contiene canali per distribuire efficacemente i nutrienti e molecole di segnalazione all’interno del biofilm stesso,
- Dispersione attiva: le cellule microbiche vengono staccate in grumi o singolarmente per colonizzare successivamente altre sedi.
L’infezione locale di una lesione cutanea inizia quindi con la colonizzazione da parte di specie microbiche in forma planctonica ovvero microorganismi singoli che si muovono liberamente e crescono rapidamente per poi organizzarsi in colonie dinamiche, protette da biofilm. L’infezione locale, in condizioni predisponenti come immunodeficienza, vasculopatia, diabete, ecc., se non correttamente trattata, può diffondendosi e potenzialmente esitare in una infezione sistemica, condizionando gravemente morbilità e mortalità.
Una delle caratteristiche del biofilm più impattanti nella gestione delle infezioni è lo sviluppo di una estrema tolleranza e protezione agli agenti antimicrobici e alle difese immunitarie fisiologiche dell’organismo. La prima protezione è attuata dallo spessore stesso del biofilm e secondariamente dalla sua composizione chimica che, attraverso la capacità di alcune molecole dell’EPS di legarsi agli antimicrobici, può degradarli o assorbirli al suo interno, permettendo alle cellule microbiche di acquisirne tolleranza; infine la riduzione del tasso di crescita e l’inattività delle cellule nel biofilm maturo sono una ulteriore strategia che permette di ridurre la suscettibilità agli antimicrobici.
La gestione delle lesioni croniche, che tendono a non guarire consuma il 2-4 % della spesa sanitaria in molti paesi, in particolare la media dei costi di gestione delle lesioni infette è tre volte superiore che per quelle non infette. La colonizzazione critica e l’infezione della lesione sono le complicanze più frequenti e innescano un ciclo costoso di trattamenti prolungati e consumo di risorse.
Attualmente, non esiste un test diagnostico validato per definire la presenza o le caratteristiche del biofilm nella ferita, né sono disponibili marcatori bio umorali quantitativi specifici. La distinzione fra infezione locale e biofilm rappresenta uno dei principali ostacoli nella scelta di una strategia di cura efficace e mirata. Tuttavia si può affermare che tutte le ferite croniche ospitano biofilm quando sono presenti i seguenti segni clinici:
- Fallimento dell’antibiotico terapia sistemica
- Segni clinici di infezione di durata >30 giorni
- Tessuto di granulazione friabile
- Presenza di materiale gelatinoso facilmente asportabile dalla superficie della ferita che si ricostituisce rapidamente.
Evoluzione degli strumenti di valutazione
La valutazione della lesione attraverso il principio del TIME (tessuto, infezione/infiammazione, bilancio umidità, epidermide) pubblicato per la prima volta nel 2003, è stata il primo passo per un approccio sistematico alla gestione delle ferite e, già dopo pochi anni, ha subito la prima evoluzione: la ‘E’ di “epidermide” nel paradigma iniziale modificata in “epidermal edge” cioè “bordo di ferita”. Nel tempo l’algoritmo ha subito ulteriori modifiche grazie all’ampio utilizzo nella pratica clinica e alla conferma della sua utilità, soprattutto nella gestione delle lesioni di difficile guarigione. Altri elementi migliorativi aggiunti nel tempo sono stati il concetto di debridement di mantenimento, l’impiego di medicazioni avanzate e di tecnologie innovative come la pressione topica negativa (NPWT) che hanno trovato la giusta collocazione nella M e nella E dell’algoritmo.
Una limitazione di questo strumento è però che si concentra solo sulle caratteristiche cliniche della ferita, motivo per cui si è concretizzata la necessità di un paradigma comprensivo della valutazione e presa in carico completa del paziente. Nel 2018, a seguito di una survey internazionale è stato quindi proposto da un panel di esperti multidisciplinare un nuovo algoritmo per guidare gli operatori sanitari nella gestione completa e continuativa del paziente: il TIME CDST (Clinical Decision Support Tool).
Continua a leggere qui: Lesioni con infezione e biofilm
Associazione Infermieristica per lo Studio delle Lesioni Cutanee – EBN