Negli ultimi anni la popolazione di pazienti che regolarmente accede ai servizi ambulatoriali di controllo periodico del dispositivo cardiaco impiantabile – CIED (PM, ICD, CRTP, CRTD, monitor cardiaci sottocutanei ILP/ICM/Reveal) è
letteralmente esplosa con conseguente rilevante incremento del carico di lavoro per i Centri di Aritmologia e Cardiostimolazione. Il follow-up dei pazienti con CIED è parte integrante del processo terapeutico, richiede controlli ambulatoriali cadenzati ed è divenuto oneroso per il numero crescente di pazienti impiantati e per la complessità tecnica dei dispositivi (Ricci e Locati et al, 2015; AIAC e ANMCO, 2020). La frequenza dei controlli, secondo le principali linee guida delle Società Internazionali di Cardiologia, prevede 1 controllo nell’immediato post-impianto, da 1 a 4 controlli annui in relazione al tipo di dispositivo e controlli ravvicinati a cadenza trimestrale per eventuali problemi legati al funzionamento del dispositivo (recall/advisory, nota tecnica delle aziende produttrici) o all’approssimarsi del “fine vita” (AIAC e ANMCO, 2020). Un limite del follow-up tradizionale (controllo in office) è
dato dall’acquisizione ritardata delle informazioni diagnostiche memorizzate dal dispositivo che, se acquisite
prontamente, possono favorire una reazione clinica tempestiva (Ricci e Locati et al, 2015).
Il controllo in office, dato il numero crescente di pazienti impiantati, difficilmente è associato ad una visita clinica e si limita, dunque, alla verifica elettrica del dispositivo (longevità; valori soglia di stimolazione/sensibilità degli elettrocateteri, sia in forma numerica sia grafica, e impedenza degli stessi, indicatore della loro integrità), ricavando le medesime informazioni di un report di un controllo programmato da remoto (Zanotto, 2016). Solo il 6.6% dei controlli in office conduce ad azioni cliniche rilevanti (AIAC e ANMCO, 2020).
Ulteriori studi clinici hanno documentato che, nell’80% dei casi, i controlli tradizionali non inducono alcuna azione clinica di riprogrammazione del dispositivo e/o modifica della terapia farmacologica (Ricci e Locati et al, 2015). Il monitoraggio intensivo mediato da controlli in office ravvicinati è oneroso e spesso inefficiente in quanto non è in grado di intercettare eventi clinici potenzialmente avversi che si verificano nell’intervallo fra le visite. Per maggiore chiarezza, è opportuno precisare una distinzione fra (1) controllo remoto (interrogazione remota), che prevede la trasmissione periodica (manuale e automatica) dei parametri elettrici, senza che il paziente sia fisicamente presente, e che può sostituire la visita ambulatoriale cadenzata, e (2) monitoraggio remoto – RM (sorveglianza remota), che include trasmissioni frequenti ad intervalli prefissati e l’invio automatico di allarmi in caso di eventi predefiniti, sia clinici sia strumentali, anch’esso senza la presenza fisica del paziente (Ricci e Locati et al, 2015; Zanotto, 2016).
In accordo con il consenso ISHNE/EHRA, il RM dei CIED consiste nella trasmissione automatica non schedulata dei dati sulla base di avvisi prestabiliti relativi al funzionamento del device e ad eventi clinici (Dubner e Auricchio et al, 2012). Tali potenzialità tecnologiche appartengono ai dispositivi dotati di automatismi dedicati (ICD, ILP, CRT-P/D, PM di ultima generazione). Biotronik, Medtronic, Abbott/St. Jude Medical, Boston Scientific e Microport/Sorin Group rappresentano le principali ditte fornitrici di CIED che, negli anni, hanno sviluppato specifici sistemi di RM per i dispositivi di loro produzione. I CIED dispongono di una serie di indicatori (diagnostiche cliniche) gestibili in monitoraggio remoto, quali la percentuale di resincronizzazione effettivamente erogata, la variabilità della frequenza cardiaca (valore HRV), la variabilità degli intervalli RR (valori SDNN e SDANN), le apnee notturne, le alterazioni del tratto ST e onda T, la capacità di movimento del paziente, le aritmie atriali e ventricolari, il burden di fibrillazione atriale e l’impedenza transtoracica, in parte correlata allo stato di congestione polmonare, indicatori di scompenso cardiaco – HF (Ricci e Locati et al, 2015; Zanotto, 2016).
Il monitoraggio puntuale e protratto del tratto ST-onda T consente di identificare gli eventuali eventi ischemici, potenziali trigger di aritmie e di evoluzione della disfunzione ventricolare sinistra (Zanotto, 2016). Ne consegue, dunque, una precoce identificazione di eventi clinicamente rilevanti e conseguente riduzione del tempo eventoreazione. Il RM non è un sistema di gestione delle emergenze e in nessun caso prevede la possibilità di riprogrammare il dispositivo (Ricci e Locati et al, 2015). La sorveglianza da remoto migliora significativamente la prognosi dei pazienti e la gestione clinica, senza comprometterne la sicurezza, riducendo tempi e costi; pertanto, può sostituire il controllo ambulatoriale tradizionale, fermo restando almeno 1 controllo in office annuo come
raccomandato dalle linee guida internazionali (Ricci e Locati et al, 2015; Slotwiner e Varma et al, 2015).
Nel 2015 l’HRS ha pubblicato un Documento di Consenso che ha attribuito al RM dei CIED una Classe di raccomandazione I con livello di evidenza A (Figura 1) (Slotwiner e Varma et al, 2015). In riferimento alle linee guida HRS, l’attività di sorveglianza da remoto dovrebbe essere garantita a tutti i pazienti con dispositivi cardiaci (Slotwiner e Varma et al, 2015; Malanchini e Ferrari et al, 2021).

FIGURA 1 – Raccomandazioni HRS.
Le linee guida ESC 2021 hanno definito la frequenza dei controlli in office e da remoto dei PM e CRT-P (Figura 2) e le raccomandazioni in merito (Figura 3) (Glikson e Nielsen et al, 2021).
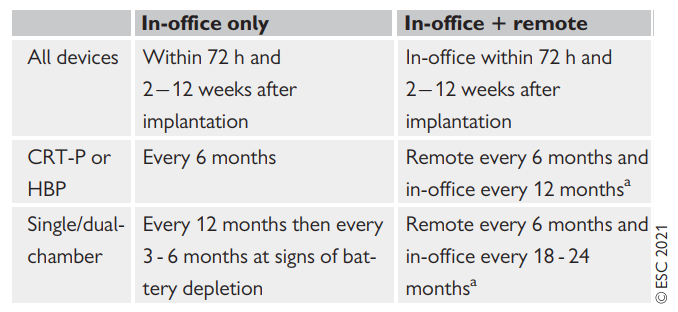
FIGURA 2 – Frequenza follow-up in office e in controllo remoto.
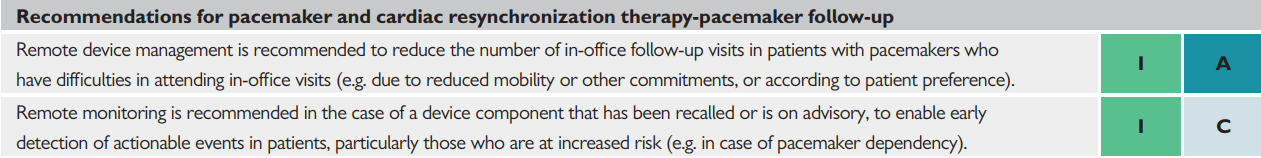
FIGURA 3 – Raccomandazioni ESC 2021.
Prosegui la lettura cliccando qui: Il monitoraggio remoto dei dispositivi impiantabili






